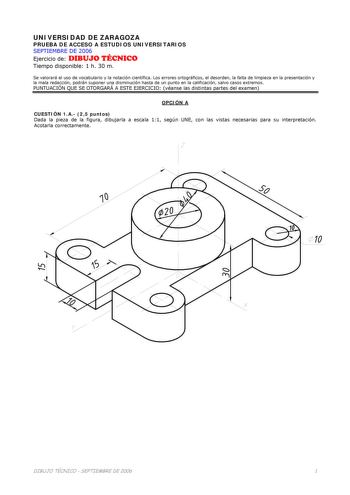
Examen de Química de Aragón (selectividad de 2006)

| Comunidad Autónoma | Aragón |
|---|---|
| Asignatura | Química |
| Convocatoria | Ordinaria de 2006 |
| Fase | General Específica |
Temas mencionados new_releases
Constante de equilibrio
En una reacción química en general: la constante de equilibrio puede ser definida como. donde es la actividad (concentración molar x coeficiente de actividad) y α el coeficiente estequiométrico de la sustancia química A y así sucesivamente. Es solo una convención el poner las actividades de los productos como numerador y de los reactivos como denominadores.
Fuente: wikipedia.orgMasa molar
La masa molar (símbolo M) de una sustancia dada es una propiedad física definida como su masa por unidad de cantidad de sustancia. Su unidad de medida en el SI es kilogramo por mol (kg/mol o kg·mol−1), sin embargo, por razones históricas, la masa molar es expresada casi siempre en gramos por mol (g/mol).
Fuente: wikipedia.org
Acetato de sodio
El acetato de sodio, o acetato sódico, también llamado etenoato de sodio, es la sal de sodio del ácido acético. Es un producto químico económico producido en cantidades industriales para una amplia gama de usos.
Fuente: wikipedia.orgApolar
Las moléculas apolares son aquellas moléculas que se producen por la unión entre átomos que poseen igual electronegatividad, por lo que las fuerzas con las que los átomos que conforman la molécula atraen los electrones del enlace son iguales. Una molécula es polar cuando uno de sus extremos está cargado positivamente, y el otro de manera negativa. Cuando una molécula es apolar, estas cargas no existen.
Fuente: wikipedia.orgÁtomo
«Átomo» proviene del griego ἄτομον («átomon»), unión de dos vocablos: α (a = sin) y τομον (tomon) que significa división ("sin división", algo que no se puede dividir). Un átomo es la unidad constituyente más pequeña de la materia que tiene las propiedades de un elemento químico. Cada sólido, líquido, gas y plasma se compone de átomos neutros o ionizados. Los átomos son muy pequeños; los tamaños típicos son alrededor de 100 pm (diez mil millonésima parte de un metro). No obstante, los átomos no tienen límites bien definidos y hay diferentes formas de definir su tamaño que dan valores diferente…
Fuente: wikipedia.org.jpg?width=300)
Notación científica
La notación científica, también denominada patrón o notación en forma exponencial, es una forma de escribir los números que acomoda valores demasiado grandes (100000000000) o pequeños (0.00000000001) para ser convenientemente escrito de manera convencional. El uso de esta notación se basa en potencias de 10 (los casos ejemplificados anteriormente en notación científica, quedarían 1 × 1011 y 1 × 10−11, respectivamente). El módulo del exponente es la cantidad de ceros que lleva el número delante, en caso de ser negativo (nótese que el cero delante de la coma también cuenta), o detrás, en caso de…
Fuente: wikipedia.orgCátodo
Un cátodo es un electrodo con carga negativa que sufre una reacción de reducción, mediante la cual un material reduce su estado de oxidación al recibir electrones.
Fuente: wikipedia.orgÁnodo
El ánodo es un electrodo en el que se produce una reacción de oxidación, mediante la cual un material, al perder electrones, incrementa su estado de oxidación.
Fuente: wikipedia.org
Gases nobles
Los gases nobles son un grupo de elementos químicos con propiedades muy similares: por ejemplo, bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja. Se sitúan en el grupo 18 (VIIIA) de la tabla periódica (anteriormente llamado grupo 0). Los siete gases son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), el radiactivo radón (Rn) y el sintético oganesón (Og).
Fuente: wikipedia.org
Ácido acético
El ácido acético (también llamado ácido metilcarboxílico o ácido etanoico) puede encontrarse en forma de ion acetato. Se encuentra en el vinagre, y es el principal responsable de su sabor y olor agrios. Su fórmula es CH3-COOH (C2H4O2). De acuerdo con la IUPAC, se denomina sistemáticamente ácido etanoico.
Fuente: wikipedia.org