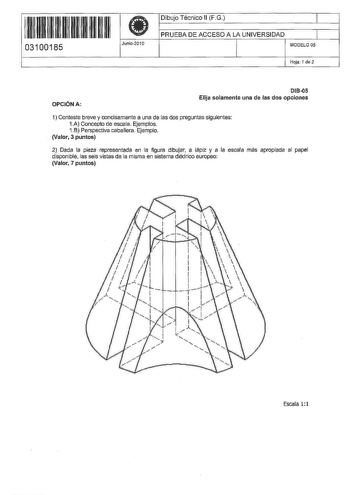
Examen de Química de la UNED (PAU de 2010)

| Comunidad Autónoma | Fuera de España (UNED) |
|---|---|
| Asignatura | Química |
| Convocatoria | Ordinaria de 2010 |
| Fase | General |
Temas mencionados new_releases

Azufre
El azufre es un elemento químico de número atómico 16 y símbolo S (del latín sulphur). Es un no metal abundante con un color amarillo característico.
Fuente: wikipedia.org
Etano
El etano (del griego aither éter, y el sufijo -ano) es un hidrocarburo alifático alcano con dos átomos de carbono, de fórmula C2H6. En condiciones normales es gaseoso y un excelente combustible. Su punto de ebullición está en -88 °C.
Fuente: wikipedia.org
Valencia (química)
La valencia es el número de electrones que tiene un elemento en su último nivel de energía. Estos electrones son los que pone en juego durante una reacción química o para establecer un enlace con otro elemento. Hay elementos con más de una valencia, por ello fue reemplazado este concepto con el de números de oxidación que finalmente representa lo mismo. A través del siglo XX, el concepto de valencia ha evolucionado en un amplio rango de aproximaciones para describir el enlace químico, incluyendo la estructura de Lewis (1916), la teoría del enlace de valencia (1927), la teoría de los orbitales …
Fuente: wikipedia.orgTabla periódica de los elementos
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
Fuente: wikipedia.orgConstante de equilibrio
En una reacción química en general: la constante de equilibrio puede ser definida como. donde es la actividad (concentración molar x coeficiente de actividad) y α el coeficiente estequiométrico de la sustancia química A y así sucesivamente. Es solo una convención el poner las actividades de los productos como numerador y de los reactivos como denominadores.
Fuente: wikipedia.orgConfiguración electrónica
En física y química, la configuración electrónica indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un átomo o atomicamente un producto de orbitales antisimetrizadas. La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.
Fuente: wikipedia.org
Disociación
Disociación en química es un proceso general en el cual complejos, moléculas y/o sales se separan en moléculas más pequeñas, iones o radicales, usualmente de manera reversible. Disociación es lo opuesto de la asociación, síntesis química o a la recombinación.
Fuente: wikipedia.org
Hidrogenación
La hidrogenación es un tipo de reacción química (redox) cuyo resultado final visible es la adición de hidrógeno (H2) a otro compuesto. Los objetivos habituales de esta reacción son compuestos orgánicos insaturados, como alquenos, alquinos, cetonas, nitrilos, y aminas. La mayoría de las hidrogenaciones se producen mediante la adición directa de hidrógeno diatómico bajo presión y en presencia de un catalizador.
Fuente: wikipedia.orgLey de Hess
En termodinámica, la ley de Hess, propuesta por Germain Henri Hess en 1840, establece que: «si una serie de reactivos reaccionan para dar una serie de productos, el calor de reacción liberado o absorbido es independiente de si la reacción se lleva a cabo en una, dos o más etapas», esto es, que los cambios de entalpía son aditivos: ΔHneta = ΣΔHr.
Fuente: wikipedia.orgEntalpía
Entalpía (del griego ἐνθάλπω [enthálpō], «agregar calor»; formado por ἐν [en], «en» y θάλπω [thálpō], «calentar») es una magnitud termodinámica, simbolizada con la letra H mayúscula, cuya variación expresa una medida de la cantidad de energía absorbida o cedida por un sistema termodinámico, es decir, la cantidad de energía que un sistema intercambia con su entorno.
Fuente: wikipedia.orgMagnesio
El magnesio es el elemento químico de símbolo Mg y número atómico 12. Su masa atómica es de 24,305 u. Es el séptimo elemento en abundancia constituyendo del orden del 2 % de la corteza terrestre y el tercero más abundante disuelto en el agua de mar. El ion magnesio es esencial para todas las células vivas. El metal puro no se encuentra en la naturaleza. Una vez producido a partir de las sales de magnesio, este metal alcalino-térreo es utilizado como un elemento de aleación.
Fuente: wikipedia.org
Óxido de nitrógeno (II)
El óxido de nitrógeno (II), óxido nítrico o monóxido de nitrógeno (NO) es un gas incoloro y poco soluble en agua, presente en pequeñas cantidades en los mamíferos. Está también extendido por el aire siendo producido en automóviles y plantas de energía. Se lo considera un agente tóxico.
Fuente: wikipedia.org
Benceno
El benceno es un hidrocarburo aromático de fórmula molecular C6H6, (originariamente a él y sus derivados se le denominaban compuestos aromáticos debido a la forma característica que poseen). En el benceno cada átomo de carbono ocupa el vértice de un hexágono regular, aparentemente tres de las cuatro valencias de los átomos de carbono se utilizan para unir átomos de carbono contiguos entre sí, y la cuarta valencia con un átomo de hidrógeno. Según las teorías modernas sobre los enlaces químicos, tres de los cuatro electrones de la capa de valencia del átomo de carbono se utilizan directamente pa…
Fuente: wikipedia.orgFuerza electromotriz
La fuerza electromotriz o voltaje inducido (representado fem, FEM o) es toda causa capaz de mantener una diferencia de potencial entre dos puntos de un circuito abierto o de producir una corriente eléctrica en un circuito cerrado. Es una característica de cada generador eléctrico. Con carácter general puede explicarse por la existencia de un campo electrostático conservativo Ecs cuya circulación, define el voltaje inducido del generador:…
Fuente: wikipedia.org